Հիմքերի շարքին են դասվում այն նյութերը, որոնց մոլեկուլում մետաղի ատոմը կապված է մեկ կամ մի քանի հիդրօքս՝ (OH), խմբի հետ։ Քիմիական ռեակցիաների ընթացքում հիդրօքս խումբը կարող է մի նյութից անփոփոխ անցնել մեկ այլ նյութի:
Հիմքերի բաղադրություններում պարունակվող հիդրօքսո՝ (OH), խումբը միավալենտ է,ուստի հիմքերի բաղադրությունը արտահայտվում է հետևյալ ընդհանուր բանաձևով՝ Me(OH)n, որտեղ Me-ն մետաղն է, իսկ n-ը թվապես հավասար է տվյալ հիդրօքսիդում Me-ի օքսիդացման աստիճանին։
Հիմքերը հիմնականում իոնային միացություններ են. կապը մետաղի ատոմի և (OH) խմբի միջև իոնային է:
Հիմքերի թվին է դասվում նաև ամոնիումի հիդրօքսիդը՝ NH4OH (այդ նյութին համապատասխանող ջրային լուծույթը կենցաղում հայտնի է անուշադրի սպիրտ
անվանմամբ)։
Հիմքերի դասակարգումը
Հիմքերը դասակարգվում են ըստ ջրում լուծվելու ունակության` լուծելի (ալկալիներ) և անլուծելի:
Ջրում լուծելի են միայն ալկալիական և հողալկալիական մետաղների հիդրօքսիդները, դրանք թվով 8-ն են՝LiOH,NaOH,KOH,RbOH,CsOH,Ca(OH)2,Ba(OH)2Sr(OH)2:
Ալկալի է համարվում նաև NH4OH-ը:
Հիմքերի ստացումը
Ալկալիները (ջրում լուծելի հիմքերը) կարող են ստացվել.
• համապատասխան մետաղի ու ջրի փոխազդեցությունից՝
2Na + 2H2O = 2NaOH + H2↑
Ba + 2H2O = Ba(OH)2 + H2↑⏐
• համապատասխան մետաղի օքսիդի ու ջրի փոխազդեցությունից՝
Li2O + H2O = 2LiOH
BaO + H2O = Ba(OH)2
Ջրում չլուծվող հիմքերն ստացվում են համապատասխան մետաղի լուծելի աղի ու ալկալու փոխազդեցությունից, օրինակ՝
CrSO4 + 2NaOH = Cr(OH)2↓ + Na2SO4
Cu(NO3)2+2KOH = Cu(OH)2↓ + 2KNO3
MnCl 2+ Ba(OH)2 = Mn(OH)2↓ + BaCl2
Հիմքերի քիմիական հատկությունները
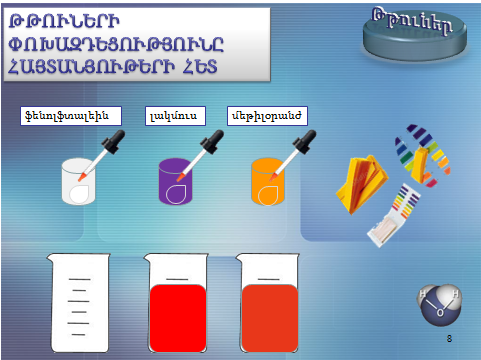
1.Հիմքերի փոխազդեցությունը հայտանյութերի հետ
Ջրում լուծելի հիմքերը` ալկալիները, գունավորում են հայտանյութերը` լակմուսը` կապույտ, մեթիլօրանժը` դեղին, իսկ ֆենոլֆտալեինը՝ մորեգույն։
2.Հիմքերի և թթուների փոխազդեցությունը
Թթուների հետ փոխազդում են և լուծվող, և անլուծելի հիմքերը՝ առաջացնելով աղ և ջուր (չեզոքացման ռեակցիա):
2NaOH + H2SO 4= Na2SO 4 + 2H2O
Cu(OH)2 + H2SO 4 = CuSO 4 + 2H2O
2KOH + H2S = K2S + 2H2O
3.Ալկալիների և թթվային օքսիդների փոխազդեցությունը
Ba(OH)2 + CO2 = BaCO3↓ + H2O
Ca(OH)2 + SO2 = CaSO3↓ + H2O
4.Ալկալիների և աղերի փոխազդեցությունը
Այս փոխազդեցությունը հանգեցնում է նոր հիմքի և նոր աղի առաջացման։ Ըստ որում` ելանյութ աղը պետք է ջրում լուծելի լինի, իսկ արգասիքների թվում կամ անլուծելի հիմք,
կամ անլուծելի աղ լինի՝
FeSO 4+ 2KOH = Fe(OH)2↓ + K2SO
4Na2SO 4+ Ba(OH)2 = BaSO 4↓ + 2NaOH
5.Ալկալիների և ոչ մետաղների փոխազդեցությունը
Ոչ մետաղներից ալկալիները փոխազդում են, հիմնականում հալոգենների հետ։ Այս դեպքում, որպես կանոն` կրկին աղ և ջուր են առաջանում, օրինակ՝
Cl2+ 2NaOH = NaCl + NaCl + H2O
6. Անլուծելի հիմքերի քայքայումը
Անլուծելի հիմքերը հիմնականում անկայուն են ու տաքացնելիս քայքայվում են` ջուր և հիմնային օքսիդ առաջացնելով, օրինակ՝
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
Ալկալիները կայուն նյութեր են, ուստի չափավոր տաքացնելիս չեն քայքայվում։
Երկդիմի հիդրօքսիդներ
Նյութերը, որոնք ցուցաբերում են և՛ թթվային, և՛ հիմնային հատկություններ, անվանվում են երկդիմի (ամֆոտեր)։
Երկդիմությունը (ամֆոտերությունը) նյութի հատկությունն է` փոխազդելու և՛ թթուների, և՛ հիմքերի հետ։
1.Երկդիմի հիդրօքսիդների և թթուների փոխազդեցությունը՝
Zn(OH)2+2HCl=ZnCl2+2H2O
Al(OH)3+3HCl=AlCl3+3H2O
2. Երկդիմի հիդրօքսիդների և ալկալիների փոխազդեցությունը՝
Zn(OH)+22NaOH=Na2ZnO2+2H2O
Al(OH)3+NaO3H=NaAlO2+2H2O