Թթուները բարդ նյութեր են, որոնց մոլեկուլները կազմված են մեկ կամ մի քանի ջրածնի ատոմներից և թթվային մնացորդից:
Բոլոր թթուների ջրային լուծույթները թթու համ ունեն և դրանք օժտված են նույնանման հատկություններով՝ իրենց բաղադրիչ տարրի՝ ջրածնի շնորհիվ:
Ոչ բոլոր թթուների լուծույթները կարելի է համտեսել. դրանց մեջ հանդիպում են հյուսվածքներ քայքայողներ, նույնիսկ թունավորներ:
Մրջունները «թշնամիներից» պաշտպանվելու նպատակով արտաթորում են մրջնաթթվի կծու կաթիլներ:

Այս նույն թթուն արկա է եղինջի տերևների «խայթող» մազիկներում:

Ցանկացած թթվի մոլեկուլի բաղադրությունը, անկախ ծագումից (օրգանական, կամ հանքային), արտահայտվում է հետևյալ ընդհանուր բանաձևով՝ HnR , որտեղ R-ը թթվային մնացորդն է, n-ը՝ ջրածնի ատոմների թիվը:
Թթվային մնացորդներն ունեն որոշակի բաղադրություն և վալենտականություն, վերջինս որոշվում է ըստ մետաղներով տեղակալվելու ընդունակ ջրածնի ատոմների թվի:Որոշ հանքային թթուների և թթվային մնացորդների անվանումները
Թթուները մեծ տարածվածություն ունեն բնության մեջ: Օրինակ՝ կիտրոնում պարունակվում է կիտրոնաթթու, խնձորի մեջ՝ խնձորաթթու, թրթնջուկի տերևներում՝ թրթնջկաթթու:
Թթուների ստացման եղանակները
Անթթվածին թթուները ստացվում են համապատասխան գազային ջրածնային միացությունները ջրում լուծելով, իսկ գազային ջրածնային միացությունները ստացվում են
ա) ջրածնի և համապատասխան ոչ մետաղի անմիջական փոխազդեցությունից.
H2+F2=2HF
H2+Br2=2HBr
H2+S=H2S
H2+Cl2=2HCl
բ) համապատասխան աղի և մեկ այլ` ավելի ուժեղ թթվի փոխազդեցությունից.
FeS+H2SO4=FeSO4+H2S↑
NaCl(պինդ) +H2SO4(խիտ) =NaHSO4+HCl↑ (լաբորատորեղանակ)
2NaCl(պինդ) +H2SO4(խիտ) =Na2SO4+2HCl↑ (արդյունաբերականեղանակ)
գ) որոշ այլ փոխազդեցություններից։
Օրինակ՝ ավելի ակտիվ ոչ մետաղները դուրս են մղում պակաս ակտիվները
համապատասխան թթուներից.
2HJ + Br2 = 2HBr + J2
H2S + Cl2 = 2HCl + SH2
S + Cl2 = 2HCl + S
Թթվածնային թթուների ստացման հիմնական եղանակ (համապատասխան օքսիդի ու ջրի փոխազդեցությունն արդեն նշվել է «Ջրածին» և «Օքսիդներ» թեմաներում):
Թթվածնային թթու է ստացվում նաև այդ թթվի աղի և այլ թթվի փոխազդեցությունից,
եթե.
ա) ստացվող թթուն, փոխազդող թթվի համեմատ` ցնդող է.
NaNO3 + H2SO4 = NaHSO4 + HNO3
բ) որպես ռեակցիայի արգասիք՝ ջրում անլուծելի աղ կամ թթու է առաջանում.
Na2SiO 3+ 2HNO3 = H2SiO3↓ + 2NaNO3
Թթուների քիմիական հատկությունները
Թթուների որոշ քիմիական հատկություններին (փոխազդեցությունը մետաղների ու մետաղների օքսիդների հետ) հանգամանորեն անդրադարձել ենք «Ջրածին» և «Թթվածին» թեմաներում։ Ուստի այստեղ կներկայացնենք թթուներին բնորոշ այլ հատկությունները:
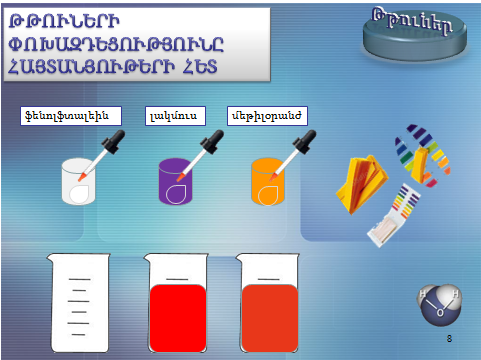
1.Թթուների փոխազդեցությունը հայտանյութերի հետ.Բոլոր թթուների ջրային լուծույթները գունավորում են հայտանյութեր՝
լակմուսը` կարմիր, մեթիլօրանժը` մուգ վարդագույն, իսկ ֆենոլֆտալեինը թթուներում չի գունավորվում:
2.Թթուների և հիմքերի փոխազդեցությունը
Թթուներին առավել բնորոշ է հիմքերի (ինչպես ալկալիների, այնպես էլ` ջրում չլուծվող) հետ փոխազդեցությունը` չեզոքացման ռեակցիան, որի հետևանքով առաջանում է աղ և ջուր.
LiOH + HCl = LiCl + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
3.Թթուների և աղերի փոխազդեցությունը
Նման ռեակցիա իրականացնելու համար անհրաժեշտ է ելանյութերն ընտրել այնպես, որ արգասիքների թվում լինի.
ա) անլուծելի թթու.
H2SO 4+ Na2SiO3= Na2SO4 + H2SiO3↓
բ) թույլ թթու.
CH3COOK + HBr = CH3COOH + KBr
գ) անկայուն թթու.
K2CO3 + 2HBr = 2KBr + CO2↑ + H2O
դ) անլուծելի աղ.
AgNO3 + HBr = AgBr↓ + HNO3
4. Որոշ թթուներ տաքացնելիս քայքայվում են.
H2SiO3= SiO2 +H2O
H2SO3= SO2 +H2O
Չեզոքացման ռեակցիա, չեզոքացում, թթվի հատկություններ ունեցող նյութերի և հիմքի հատկություններ ունեցող նյութերի միջև ընթացող քիմիական ռեակցիա, որի հետևանքով այդ նյութերը կորցնում են թթուներին ու հիմքերին բնորոշ հատկությունները։
Պատասխանել հարցերին
- Որոշե՛ք թթու առաջացնող տարրերի օքսիդացման աստիճանը հետևյալ թթուններում.
HNO3, H2SiO3 ,HNO3 , HCIO4 , H3PO4
H+1NO2-1
H+12SiO3-2
H+1NO3-1
H+1ClO4+1 - Ո՞ր ռեակցիաներն են անվանվում չեզոքացման :
Չեզոքացման ռեակցիա, չեզոքացում, թթվի հատկություններ ունեցող նյութերի և հիմքի հատկություններ ունեցող նյութերի միջև ընթացող քիմիական ռեակցիա, որի հետևանքով այդ նյութերը կորցնում են թթուներին ու հիմքերին բնորոշ հատկությունները։ - Գրե՛ք հետևյալ փոխարկումներին համապատասխանող քիմիական ռեակցիաների հավասարումները.
S- SO2-SO3-H2SO4— BaSO4